Tout commence par un besoin médical
Face à une population de pathologistes en tension, une charge de travail en hausse et des attentes accrues en matière de complétude et de précision des diagnostics, les défis de l’anatomopathologie se multiplient. Complexité des images, variabilité d’interprétation entre médecins, évolution constante des pratiques et recommandations, enjeux pour les patients, pression réglementaire… tout cela accentue la charge mentale des professionnels.
Dans ce contexte, l’intelligence artificielle (IA) s’impose comme un levier d’amélioration puissant, capable d’automatiser certaines tâches, d’apporter plus d’objectivité et de gagner en efficience. Elle agit comme un soutien à l’expertise humaine, sans la remplacer, et contribue à fiabiliser les diagnostics voire à les augmenter.
Mais pour qu’une solution d’IA soit réellement utile aux pathologistes, encore faut-il qu’elle réponde à un besoin médical bien identifié. La conception d’un algorithme commence donc toujours par une phase de réflexion stratégique : quel problème clinique cherche-t-on à résoudre ? Cette étape prend en compte la pertinence médicale du besoin, son impact potentiel en pratique, la présence ou non de solutions existantes, et bien sûr, la faisabilité technique du projet. À partir de là, l’usage prévu de l’outil est défini : apportera-t-il un gain de temps ? une meilleure précision ? une information nouvelle ?
Il faut également projeter l’utilisation de cet outil dans le contexte concret d’utilisation : il doit répondre à un besoin médical concret et être techniquement réalisable, mais doit également s’intégrer facilement dans le quotidien des médecins et rester économiquement viable. Il est primordial de penser dès la genèse à l’intégration de cet outil dans le workflow du praticien et en tenant compte des contraintes et ressources IT. L’objectif est d’orchestrer au mieux sa prise en main et son fonctionnement de manière à conserver la proposition de valeur en conditions réelles. C’est en conciliant ces différentes exigences que l’algorithme d’IA devient un véritable outil au service du diagnostic.
Construire une base de données annotées de haute qualité
Une fois le besoin bien défini, la première étape concrète de développement consiste à constituer une base de données solide. Cela implique de rassembler un grand nombre d’images représentatives, couvrant différents sous-types de pathologies et reflétant la diversité des pratiques de préparation et de numérisation.
Plus l’algorithme visé est complexe, plus il faudra de données – parfois plusieurs milliers d’images. Ces données doivent être de bonne qualité, c’est-à-dire nettes, sans artefacts techniques, et avec un niveau de grossissement adapté. Leur niveau de qualité doit toutefois être maintenu à un standard de pratique en routine afin que l’algorithme soit applicable et performant sur des données réelles.
La confidentialité et l’éthique sont également essentielles : obtention du consentement des patients, dé-identification de leurs données, prise en compte des biais et de l’équité.
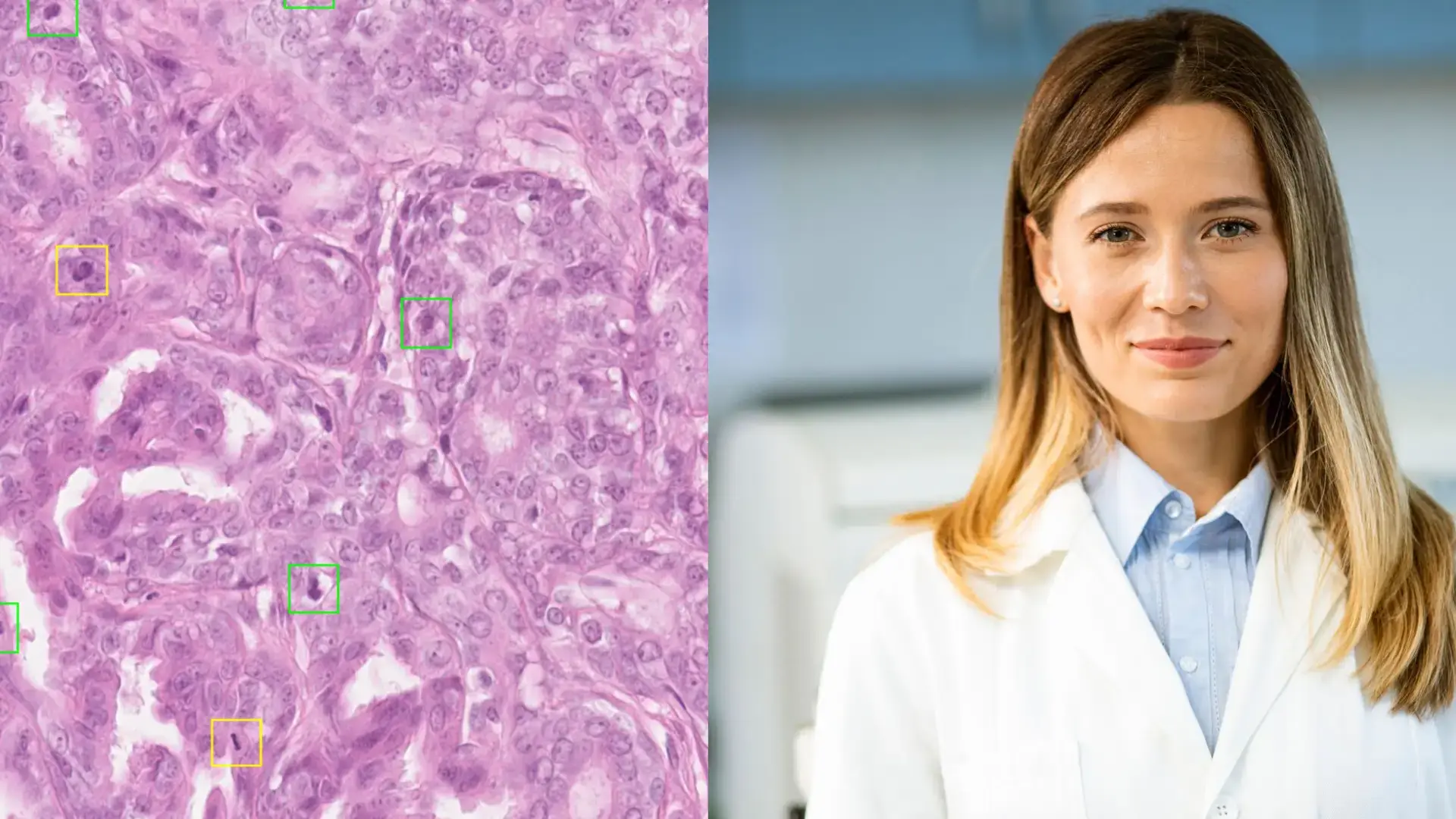
Enfin, dans le cas d’approches dites “supervisées” tel que décrit ci-après, il est nécessaire que les données soit enrichies d’annotations qui ont pour objectif d’identifier manuellement les éléments intéressants de chaque image pour que le modèle les prenne spécifiquement en compte (une cellule positive, une cellule négative, une mitose, une zone dite “tumorale”, ...). Ces annotations doivent être réalisées de manière rigoureuse pour définir ce qu’on appelle la « vérité terrain ». Parfois, la complexité de la tâche et la subjectivité de l’opérateur rend cette vérité terrain délicate à établir. Elle est donc réalisée par un expert, et plus souvent par un consensus de plusieurs pathologistes. Elle peut aussi s’appuyer sur des colorations ou tests spécifiques. Dans certains cas, le suivi clinique du patient permet aussi de confirmer le diagnostic, enrichissant ainsi la qualité de l’annotation.
C’est un travail long et minutieux incontournable, car l’algorithme va apprendre exactement à partir de ce qu’on lui montre. Une annotation imprécise peut entraîner une IA biaisée ou inefficace.

Sélection du modèle et entrainement de l’algorithme
Une fois les images annotées collectées, l’étape suivante consiste à choisir le bon type de modèle d’intelligence artificielle, selon ce que l’on veut que l’algorithme fasse. En pathologie digitale, plusieurs approches sont possibles :
- Classification : le modèle apprend à reconnaître différents types d’images, par exemple différencier un cancer bénin d’un cancer malin.
- Détection : il identifie automatiquement des zones précises sur l’image, comme des régions suspectes.
- Segmentation : il découpe l’image pour isoler des éléments comme des cellules ou des tissus.
- Génération d’images : il peut créer des images synthétiques utiles pour s’entraîner ou pour simuler des situations rares.
Ensuite, il faut choisir la méthode d'entraînement de l’algorithme :
- Supervisé : Il s’agit de la méthode d’entraînement la plus explicable et la plus transparente pour les utilisateurs, ce qui favorise leur confiance dans le modèle. Toutefois, elle nécessite un investissement conséquent en temps et en ressources, en raison du volume important d’annotations précises requises.
- Semi-supervisé ou faiblement supervisé : ici, les images ont peu ou pas d’annotations. L’algorithme apprend à partir d’étiquettes générales (comme un diagnostic global ou l'efficacité d’une thérapie spécifique), ce qui permet de gagner du temps, mais il peut repérer des éléments différents de ceux qu’un humain ciblerait.
- Non-supervisé : aucune annotation n’est utilisée. L’algorithme découvre seul des similarités ou des motifs dans les images. Cette approche peut être utile pour explorer des données, mais elle manque souvent de transparence et n’est pas encore adaptée aux applications cliniques.
De la recherche au produit : le passage à l’échelle
Développer un algorithme performant en laboratoire n’est qu’un début. Pour qu’un outil d’intelligence artificielle puisse être utilisé en pratique clinique, il doit franchir plusieurs étapes de validation rigoureuses.
La première est la validation analytique, aussi appelée validation interne. Elle consiste à tester l’algorithme sur les données utilisées pendant l’entraînement, afin de vérifier sa performance technique. On mesure notamment sa capacité à bien identifier les cas positifs (sensibilité) et à éviter les erreurs de diagnostic (spécificité). Cela permet de s’assurer que l’outil est fiable sur le plan algorithmique.
Vient ensuite la validation clinique, ou validation externe. Cette fois, le modèle est évalué sur de nouvelles données, provenant d’autres hôpitaux ou laboratoires. L’objectif est de tester sa capacité à généraliser, c’est-à-dire à rester performant dans des conditions différentes de celles de développement.
Ces deux validations permettent d’évaluer et de démontrer la performance analytique et le performance clinique de l’algorithme. Elles concernent directement la qualité des soins et la sécurité des patients. Elles sont essentielles pour obtenir les autorisations réglementaires en Europe.
Enfin, la dernière étape consiste à démontrer l’utilité clinique du modèle. Il ne suffit pas qu’il fonctionne bien : il est nécessaire de prouver qu’il apporte un réel bénéfice dans la prise en charge des patients. Cela peut se faire à travers des essais prospectifs, qui suivent des patients sur une période donnée pour observer l’impact de l’outil en situation réelle, c’est-à-dire issues de la pratique quotidienne dans les hôpitaux ou les laboratoires.
Une fois ces bénéfices clairement démontrés, il devient possible d’engager le processus réglementaire en vue d’une approbation par les autorités sanitaires compétentes dans chaque juridiction. La première étape consiste généralement à obtenir la certification en tant que dispositif médical (DM), conformément aux réglementations en vigueur — comme le marquage CE dans le cadre du Règlement sur les dispositifs médicaux de diagnostic in vitro (IVDR) dans l’Union européenne, ou l’autorisation de la FDA selon les procédures applicables aux États-Unis — pour les outils d’aide au diagnostic destinés à un usage clinique de routine. Une deuxième étape, distincte et non systématique, peut consister à soumettre une demande de remboursement ou de prise en charge, en fonction du système de santé, du type d’outil d’IA et de sa proposition de valeur démontrée. À ce jour, le remboursement de dispositifs médicaux intégrant l’IA en pathologie reste extrêmement rare à l’échelle mondiale, avec seulement quelques précédents dans certaines juridictions.
De la conception à l’évaluation clinique, chaque étape est cruciale pour garantir la fiabilité et l’utilité d’un algorithme en pathologie digitale. À l’issue de ce parcours, l’IA devient un véritable allié au service des soignants et des patients.
Restez Connectés ! 
Suivez-nous sur LinkedIn pour découvrir les dernières innovations en pathologie numérique et IA. Ne manquez pas les tendances et avancées qui façonnent l'avenir de la santé ! 🚀🔍 #SuivezNous #PathologieNumérique #Innovation #TribunHealth





.png?width=256&height=256&name=customer-service(1).png)



.png?width=64&height=64&name=calendrier(1).png)
.png?width=64&height=64&name=communique-de-presse(1).png)
.png?width=64&height=64&name=livre(1).png)
.png?width=64&height=64&name=blog(2).png)